“几天不见你又瘦了哦”。
“哪有啊”,自谦的同时,脸上洋溢着小时候收压岁钱的表情。
时至今日,人们往往地将“瘦”视为一种称赞。
据世界卫生组织统计,近半个世纪以来,全球肥胖(Obesity)的发病率增加了两倍;截至2025年,预计将威胁超过25亿成年人的身体健康情况。肥胖人群中,诸如2型糖尿病、心血管疾病、恶性肿瘤、骨关节炎等相关疾病的发病率大大增加。目前,肥胖已成为继吸烟、饮酒之后最大的癌症诱因。
可喜的是,近日,中山大学附属第六医院药学部黎小妍主任团队在Nature子刊Nature Communications(Q1,IF:13.78)发表了题为:Adipose-specific deletion of the cation channel TRPM7 inhibits TAK1 kinase-dependent inflammation and obesity in male mice的研究论文。

另外,中山大学附属第六医院骨科黄保丁博士联合哥伦比亚大学相关研究人员,在期刊Nature Nanotechnology和Biomaterials上发表了靶向治疗肥胖的最新科研成果——“正电荷减肥疗法”。黄保丁与万钱芬博士为这两篇论文的第一作者,哥伦比亚大学强力与 Kam Leong 教授为这两篇论文的通讯作者。


药学部黎小妍团队:肥胖及相关代谢疾病治疗新靶点
中山大学附属第六医院药学部黎小妍团队的研究成果揭示了TRPM7-Ca2+-TAK1信号紊乱在肥胖过程中脂肪组织炎症中的重要作用,证实了脂肪细胞TRPM7通过介导Ca2+内流调控TAK1-NFκB炎症通路,继而有效启动炎症因子转录,从而促进脂肪组织炎症,并诱导系统性胰岛素抵抗和其他肥胖并发症的发生。
这项研究表明,靶向脂肪组织TRPM7的治疗方法可能是治疗肥胖、胰岛素抵抗及其相关代谢性并发症的有潜力的新策略,为临床开发相关潜在治疗肥胖药物提供新思路。
TRPM7为非选择性阳离子通道,对多种生理及病理过程具有调控作用,包括炎症信号调控,但大多数TRPM7参与的炎症反应调控研究集中于免疫细胞。研究团队发现,肥胖小鼠脂肪细胞TRPM7表达及活性均上调,继而构建TRPM7脂肪细胞特异性敲除小鼠,发现TRPM7脂肪敲除具有改善糖耐量及胰岛素抵抗的作用,并且可以抵抗高脂诱导的肥胖,与抑制脂肪组织炎症反应相关。研究进一步证实,TAK1作为TRPM7-Ca2+信号的下游调控TRPM7介导的脂肪细胞炎症反应。于此基础上,研究团队在体给予TRPM7抑制剂,证实了药理学阻断TRPM7具有缓解脂肪组织炎症及胰岛素抵抗的作用。
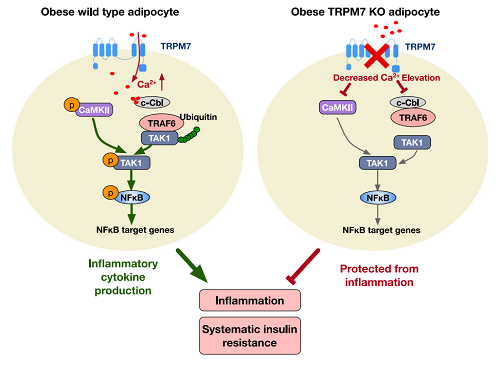
综上所述,黎小妍团队的研究揭示了TRPM7-Ca2+-TAK1信号在肥胖过程中脂肪组织炎症的作用,靶向脂肪组织TRPM7的治疗方法可能是治疗肥胖、胰岛素抵抗及其相关代谢性并发症的具有潜力的新策略。
骨科黄保丁博士团队:“正电荷减肥疗法”
通过重编程脂肪细胞的分化及脂质的合成、积聚过程,中山六院骨科黄保丁团队发现第三代正电荷树枝状大分子聚酰胺胺(PAMAM),即P-G3,这一带正电的纳米材料可以使人体获得更加健康的脂肪细胞。
考虑到脂肪组织中容纳和支撑脂肪细胞的细胞外基质含有大量负电成分,团队研讨后提出假设:这种负电基质网络或许类似某种高速公路系统,可以把正电分子快速送抵脂肪细胞。
为了验证这一猜想,研究团队将带正电P-G3腹腔注射到肥胖小鼠体内,随后发现P-G3迅速扩散到内脏脂肪中。为了进一步证实正电荷是靶向脂肪组织的关键因素,研究人员将另外两种带正电但结构不同的阳离子聚合物注射到小鼠体内,也观察到相似的现象;此外,与P-G3结构类似的负电聚合物完全不具有对脂肪组织的靶向性。至此,研究团队找到了靶向脂肪细胞的钥匙---“正电荷”。

阳离子聚合物P-G3选择性分布于内脏脂肪
发现正电荷P-G3能靶向脂肪组织后,研究团队分别给在肥胖发生过程中和已经肥胖的两组小鼠注射P-G3,结果发现P-G3既能预防肥胖发生,又能治疗已有肥胖。随着体重的降低,小鼠的炎症指标和代谢指标也出现明显改善。
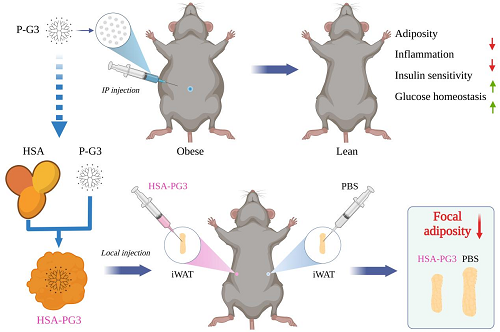
P-G3局部注射可实现精确定位,定点减肥
随后,研究团队深入细胞水平,进一步探究P-G3对脂肪细胞的作用原理和潜在机制。
成熟的脂肪细胞由前脂肪细胞分化而来,分化后的脂肪细胞开始合成并储存甘油三酯等脂质成分。机体需要时,脂质可以从细胞内释放出来提供能量或发挥其他作用。肥胖患者体内脂肪细胞的存储能力往往在达到极限后产生代谢抵抗,最终诱发一系列代谢性疾病。
黄保丁博士介绍道,通过调控NAD+以及mTOR 信号通路,P-G3对分化进程起到独特的解耦联作用,促进前脂肪细胞向脂肪细胞的分化,同时抑制脂质积累而导致的细胞肥大,从而获得更加健康的脂肪细胞。更加令人兴奋的是,除了实验对象小鼠,P-G3在人源脂肪细胞和脂肪组织中也表现出了相同的功能。这一发现,为P-G3的临床转化提供了重要的依据。
最后,研究团队围绕P-G3展开进一步优化。一方面,在末端氨基共价结合疏水胆固醇基团,进而自组装形成P-G3为壳、胆固醇链为核心的两亲性阳离子纳米颗粒。该纳米颗粒不仅保留了减肥的效果,而且在载药的同时具备更强的内脏脂肪靶向性。另一方面,利用人血白蛋白(HSA)无毒、免疫原性低等特点,开发出能够局部应用的HSA-PG3缓释纳米材料。HSA-PG3表现出精确的局部脂肪定位和显著的定点减肥效果,能够有效避免进入血液循环和其他组织,从而尽可能地提高安全指数。
黄保丁博士表示,这一开创性研究成果不仅为靶向脂肪组织提供了全新的思路,而且为正电高分子材料用于肥胖等代谢性疾病的治疗奠定了坚实的基础。

(本文图片由医院提供)