2024年7月25日,中山大学肿瘤防治中心孙颖、马骏、吕佳蔚团队在国际顶级肿瘤期刊《癌细胞》(Cancer Cell)上在线发表研究成果:治疗中循环肿瘤DNA作为癌症患者实时动态风险监测的生物标志物:EP-SEASON研究。该研究以鼻咽癌作为研究模型,通过动态追踪患者血浆中的游离Epstein-Barr病毒DNA(cfEBV DNA,一种循环肿瘤DNA)成功实现了对患者治疗响应性和复发转移风险的实时监测,为开展个体化治疗提供了可靠的生物标志物,研究结果有望帮助患者定制基于实时复发转移风险的个体化治疗策略。

各种抗肿瘤治疗(如放疗、化疗、靶向治疗等)在缩小肿瘤的同时也会触发肿瘤细胞自身及其所在微环境不断演进。值得注意的是,这些改变反过来又会进一步影响抗肿瘤治疗疗效。因此,在临床上,患者的复发转移风险并非一成不变,而是随着治疗的进行动态地发生着改变。理论上,重复进行肿瘤组织活检获取这一信息是最为可靠的方案,但是由于其有创性,临床上的应用受到极大的限制,患者接受度低。因此,目前尚缺乏简便可靠的手段来准确、实时地监测抗肿瘤治疗疗效和患者复发转移风险。
利用人体体液作为标本来源检测获取肿瘤相关信息的技术被称为“液体活检”。这项技术作为一种新兴、无创的疾病诊断和监测工具,目前主要被应用于疾病筛查和残留病灶检测。那么,“液体活检”能否应用于肿瘤患者治疗疗效和疾病复发风险的实时监测呢?
流行病区的鼻咽癌与Epstein-Barr病毒(EBV)感染密切相关。鼻咽癌细胞可以释放游离病毒DNA入血,每个癌细胞平均包含高达50个EBV拷贝,因此其可以通过液体活检技术被敏感地检测。基于此,研究者以该疾病作为模型,开展了一项前瞻性、大样本的观察性队列研究。研究共收集了1000例接受根治性放化疗的鼻咽癌患者治疗过程中12个时间点的外周血(12个检测时间点分别是:治疗开始前、每程新辅助化疗后、放疗期间每周、放疗结束后1周以及放疗结束后1-3月),首次完整地绘制了诱导化疗以及放疗过程中cfEBV DNA的动态变化图谱(图1)。
研究者发现,在新辅助化疗阶段,cfEBV DNA的清零率随着治疗的进行逐渐升高,但清零速率却随着疗程的进行显著降低;特别是进入第三程诱导化疗后,仅有6.3%的患者cfEBV DNA可以清零。值得注意的是,一旦进入放疗阶段,cfEBV DNA的清零速率又会重新升高并呈现出独特的规律:在放疗第1周和第3周出现两个高峰,而到了第4周后清零速率则降至极低水平(4.9%)。
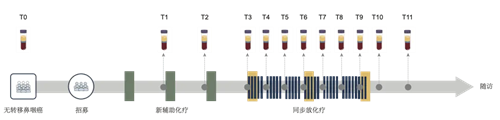
图1.EP-SEASON研究设计及外周血采集概况
研究者进一步发现,治疗中cfEBV DNA的动态变化与患者的治疗响应性和复发转移风险之间呈现出密切的联动关系。cfEBV DNA快速清零的患者,肿瘤迅速缩小,治疗响应性好;而cfEBV DNA持续升高的患者,肿瘤则不断增大,治疗响应性差。此外,患者的3年无病生存率会随着cfEBV DNA清零的延迟而呈现持续下降的趋势。值得注意的是,对于新辅助化疗期间cfEBV DNA未清零而放疗开始后2周内迅速清零的患者并非遵从这一规律。这部分患者的3年无病生存率可以达到90%,媲美接受1程新辅助化疗后cfEBV DNA即迅速清零的患者(图2)。这说明即便患者对新辅助化疗不敏感,但如果及时转入放疗且其对放疗敏感,那么患者的远期肿瘤复发转移风险仍然很低。
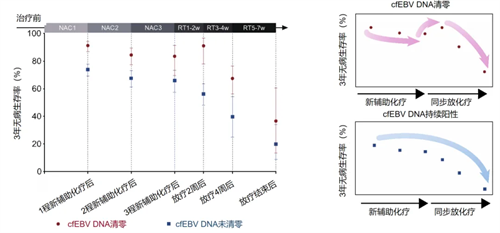
图2. 治疗中动态cfEBV DNA与患者3年无病生存率联动关系图
基于以上结果,研究者利用无监督聚类的方法,根据各时间点cfEBV DNA清零分组间的危险比(Hazard ratio)将患者划分为早反应型-type A、早反应型- type B、中等反应型、迟反应型- type A、迟反应型- type B和治疗抵抗型。在既往研究(Lv et al。 Nat Commun, 2019)的基础上进一步完善了这一基于cfEBV DNA清零规律的分型体系(图3)。
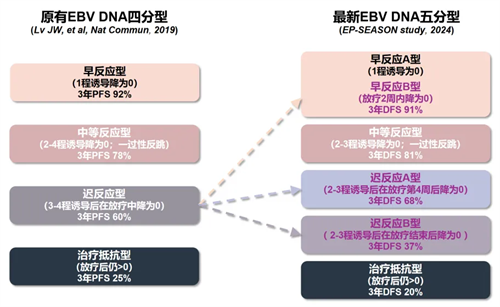
图3.基于治疗中动态cfEBV DNA的分型体系
最后,研究者探究了各时间点cfEBV DNA清零和未清零患者潜在有效的治疗策略,并提出利用治疗中cfEBV DNA的动态清零情况来帮助患者定制基于实时复发风险的个体化治疗策略,而非现有的“一成不变”的治疗模式(图4)。
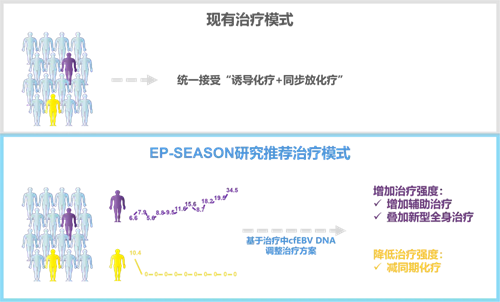
图4. 基于治疗中cfEBV DNA的“风险适应性”个体化治疗策略
那么,生物标志物指导下的“风险适应性”治疗策略能否有望提高患者的生存呢?研究者进一步开展了一项II期、多中心、伞式临床试验(EP-STAR研究),研究正在进行中,目前已完成患者入组。期待这项研究未来能为这一问题提供更多答案。
中山大学肿瘤防治中心孙颖教授、周冠群副主任医师、陈雨沛副主任医师、马骏教授为该论文的共同通讯作者。中山大学肿瘤防治中心吕佳蔚博士、徐凌芯博士、李智轩博士、林丽副主任医师、吴晨飞博士为共同第一作者。
