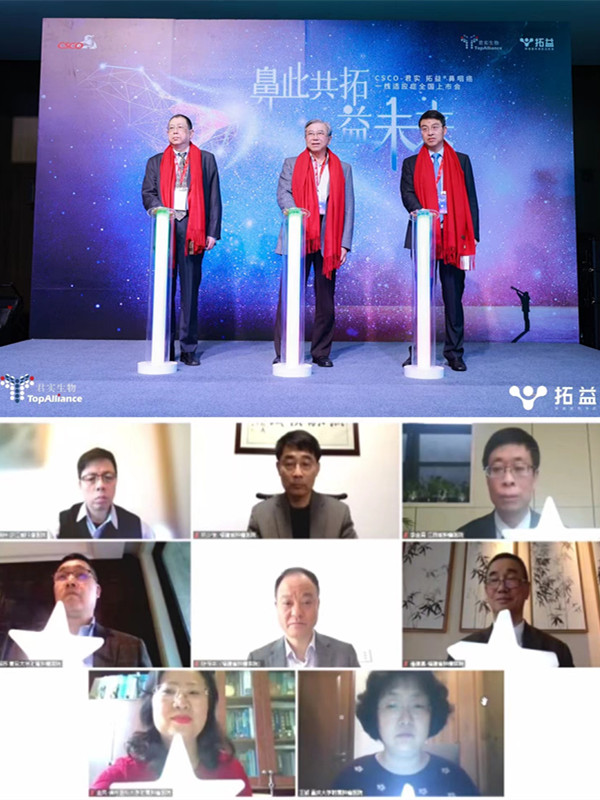
2023年11月4日,“国际品质,实力定益”拓益®鼻咽癌适应证美国获批上市新闻发布会在广州顺利召开,详细展示了我国自主研发的抗PD-1单抗药物特瑞普利单抗(美国商品名:LOQTORZI™),作为FDA批准上市的首个中国自主研发和生产的创新生物药,在临床研究及注册申报上市过程中的经历。中山大学肿瘤防治中心徐瑞华教授、麦海强教授、陈秋燕教授、王风华教授,广州医科大学附属肿瘤医院陈冬平教授,复旦大学附属肿瘤医院胡超苏教授,福建省肿瘤医院林少俊教授,中国医学科学院肿瘤医院易俊林教授,广东医科大学附属医院温继育等权威专家,以及君实生物全球研发总裁邹建军、高级副总裁姚盛博士等嘉宾出席了会议。
鼻咽癌是一种发生于鼻咽部黏膜上皮的恶性肿瘤,是常见的头颈部恶性肿瘤之一。据世界卫生组织统计,2020年鼻咽癌在全球范围内确诊的新发病例数超过13万。由于原发肿瘤位置的原因,很少采用手术治疗,针对局限性癌症主要采用放疗或放化疗结合进行治疗。此前,美国尚无疗法获批用于治疗鼻咽癌,此次FDA的批准使得特瑞普利单抗成为美国首个且唯一获批用于鼻咽癌治疗的药物,填补了美国鼻咽癌的治疗空白。
本次特瑞普利单抗在美国获批的2项适应症覆盖了复发/转移性鼻咽癌的全线治疗,分别为:1)特瑞普利单抗联合顺铂/吉西他滨作为转移性或复发性局部晚期鼻咽癌成人患者的一线治疗;2)特瑞普利单抗单药治疗既往含铂治疗过程中或治疗后疾病进展的复发性、不可切除或转移性鼻咽癌的成人患者。该审评结果主要基于JUPITER-02(一项针对一线治疗鼻咽癌的随机、双盲、安慰剂对照、国际多中心Ⅲ期临床研究,NCT03581786)及POLARIS-02(一项针对二线及以上治疗的复发或转移性鼻咽癌的多中心、开放标签、Ⅱ期关键注册临床研究,NCT02915432)的研究结果。两项研究由徐瑞华教授担任主要研究者,中国大陆、中国台湾、新加坡超过40家临床中心参与。
像鼻咽癌这类中国高发肿瘤,由于地域性高发的特点,欧美国家对此类瘤种的新药研发长期处于滞后状态。为解决我国乃至全球鼻咽癌患者未被满足的临床需求,我国临床专家与本土创新药企君实生物合作,自2016年开始在鼻咽癌治疗领域尝试新兴免疫疗法,开展后线至一线治疗“全线贯穿”的临床布局。
研发团队通过Ⅰb/Ⅱ期的小样本量探索性研究,以及Ⅱ期注册临床研究(POLARIS-02)结果,敏锐地洞察到特瑞普利单抗在鼻咽癌治疗上的潜力,随即启动全球规模最大的免疫加化疗国际多中心一线治疗鼻咽癌的Ⅲ期临床试验(JUPITER-02)。这两项临床研究的结果分别发表在国际著名期刊《临床肿瘤学杂志》(Journal of Clinical Oncology,影响因子:45.3)和《自然-医学》(Nature Medicine,影响因子:82.9)。
JUPITER-02、POLARIS-02主要研究者,中山大学肿瘤防治中心徐瑞华教授表示:“在我国众多肿瘤学专家的辛勤耕耘及探索下,近年来我国肿瘤领域研究进展迅猛。国际交流越来越频繁,中国方案越来越被认可,领域内中国的声音也越来越响亮。中国在全球属于鼻咽癌高发区域,作为中国肿瘤领域的临床专家,我们有责任为中国乃至全球的鼻咽癌患者探寻出切实满足其治疗需求、能帮助其实现更长生存获益的治疗方案。FDA的批准使得我们中国研究者的方案,以及中国原研的创新生物药有机会成为全球鼻咽癌的标准疗法,造福全球肿瘤患者!特瑞普利单抗鼻咽癌适应症在美国的获批只是一个开始,未来,我们期待特瑞普利单抗及更多的中国创新药物,为更多国家、更多肿瘤类型的患者带去好的治疗选择!”

徐瑞华教授在会上致辞
中山大学肿瘤防治中心麦海强教授介绍了JUPITER-02研究的相关情况:与单纯化疗相比,特瑞普利单抗联合化疗可显著延长患者的无进展生存期(PFS)和总生存期(OS)。“相比化疗,特瑞普利单抗联合疗法使患者的疾病进展或死亡风险降低48%,中位PFS翻了3倍,达到21.4个月,OS具有临床意义和统计学意义的双重改善,将患者的死亡风险降低37%,3年OS率达到64.5%,且未发现新的安全性信号,有望提升晚期鼻咽癌患者实现长生存的可能。”

麦海强教授介绍JUPITER-02研究亮点
据中山大学肿瘤防治中心王风华教授介绍,POLARIS-02研究结果显示,特瑞普利单抗在既往化疗失败的复发/转移性鼻咽癌患者中表现出持久的抗肿瘤活性和可接受的安全性,患者ORR为20.5%,DCR为40.0%,中位OS达17.4个月。“POLARIS-02开创了免疫药物用于鼻咽癌治疗的新纪元,让那些曾经处于无药可医境遇的患者拥有了新的希望。”

王风华教授介绍POLARIS-02研究亮点
2023年8月至9月,按照人用药品技术要求国际协调理事会(ICH)的要求,FDA核查专家对两项临床研究的研究中心——中山大学肿瘤防治中心、广州医科大学附属肿瘤医院、广东医科大学附属医院,进行了非常严格和细致的现场核查。特别关注了主要研究者和/或参与研究者在临床试验中的作用、如何管理研究团队、如何招募受试者、如何保证受试者的安全性,临床试验出现问题时主要研究者如何知悉、如何整改,主要研究者如何与伦理委员会沟通,以及主要研究者对临床试验流程、试验方案的熟悉程度等。
三家临床研究单位均顺利通过了FDA的现场核查,FDA对中国临床研究机构研究水平给予了充分认可,认为临床试验机构流程清晰,管理精细,质控严格;试验数据客观真实可靠,研究实施符合方案要求,研究团队成员尽职尽责,严谨的工作方式保证了临床试验质量。

陈冬平教授(线上)、温继育(左)教授介绍FDA临床核查情况,
易俊林教授(中)参与讨论,陈秋燕教授(右)担任主持
君实生物全球研发总裁邹建军博士表示:“特瑞普利鼻咽癌适应症在美国的获批凝聚了君实人10年的努力,也凝聚了中国的智慧和努力,是首次用中国免疫方案解决世界问题。此次在美国获批不仅意味着我们的新药研发、临床、生产及质量体系获得了国际监管机构的全方位认可,也将很大程度上进一步推进君实生物国际化布局的进程,目前公司在欧盟、英国、澳大利亚也取得了新药上市申报方面的进展,涉及多个适应症。遵循公司‘立足中国,布局全球’的国际化战略,我们将继续携手合作伙伴,全力推动特瑞普利单抗在更多地区的商业化落地,为更多海外患者提供来自中国的高质量创新药物。”

邹建军博士在会上致辞
家庭医生在线(www.familydoctor.com.cn)原创内容,未经授权不得转载,违者必究,内容合作请联系:020-37617238